近日,肝胆外科-减重与代谢外科亚专业杨威教授团队在Nature子刊、细胞分子生物医学领域国际顶级期刊《Cell Death & Differentiation》(IF=13.72,中科院一区)发表了题为“A novel hypoxia-induced lncRNA, SZT2-AS1, boosts HCC progression by mediating HIF heterodimerization and histone trimethylation under a hypoxic microenvironment”的研究成果。我院为论文的第一单位及通讯单位,肝胆外科刘青光教授、杨威教授为论文的共同通讯作者,王宇锋助理研究员为论文的末位通讯作者,刘润坤博士为论文的第一作者,郭翼贤硕士为论文的共同第一作者。该成果获得了国家自然科学基金、陕西省重点研发计划等多个项目的资金支持,是团队成员王宇锋继2021年在Science子刊《Science Advances》上首次报道瓜氨酸化酶PADI4在肝癌缺氧微环境中的作用机制之后的又一重大进展。

缺氧微环境是肝癌等实体肿瘤的内在固有微环境,以转录因子HIF-1为主的缺氧诱导因子(HIFs)在细胞适应缺氧微环境的过程中发挥着核心调控作用。 HIF-1的HIF-1α亚基需要与其异源二聚体伴侣HIF-1β相互结合才能具有转录活性。该研究在肝细胞癌(HCC)中鉴定了一个新型促癌且能够被HIF-1转录激活的靶基因lncRNA SZT2-AS1,并发现其至少在HCC的生长、侵袭、转移和血管生成方面具有促进作用。进一步深入研究发现,SZT2-AS1可以反过来介导HIF-1α与HIF-1β结合形成HIF-1异源二聚体,并作为转录共激活因子介导HIF-1对靶基因的转录调控;此外,SZT2-AS1还能通过招募组蛋白甲基转移酶SMYD2促进组蛋白的甲基化修饰从而导致染色质结构重塑,为HIF-1结合至靶基因的转录位点提供更多的物理空间和结合可能性。综上,在HCC的缺氧微环境中,SZT2-AS1通过正反馈通路影响HIF-1异源二聚体形成和转录活性并介导组蛋白的甲基化修饰,从而促进缺氧靶基因的转录进而促进HCC进展。该研究成果不仅深入揭示了HCC的表观遗传调控新机制,还为HCC的新型靶向治疗药物的研发提供了新的策略。
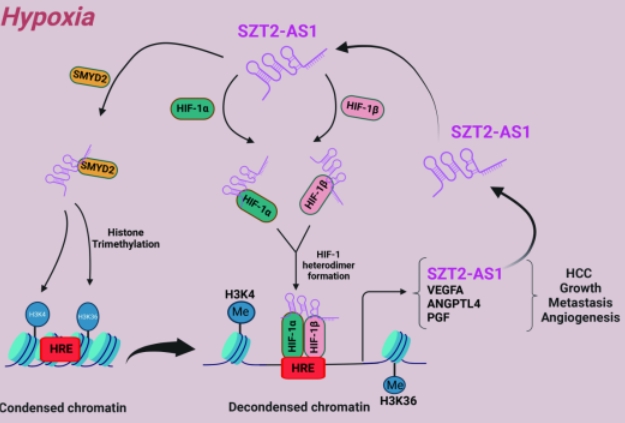
SZT2-AS1在HCC中的作用机制图
减重与代谢外科杨威教授团队近年来在肝脏良恶性肿瘤和减重代谢外科领域的临床及学术研究方面取得了长足发展。临床方面,不仅常规开展肝脏手术、脾脏切除及复杂的肝胆手术,在国内率先开展单孔腹腔镜以及减孔腹腔镜技术,并于2011年开始开展减重手术治疗肥胖及2型糖尿病。尤其在减重手术方面,从第一例“西北第一胖”手术到现在常规开展的腹腔镜袖状胃切除术、腹腔镜胃旁路术、腹腔镜单吻合口胃旁路术等,团队始终重视新术式、新理念在临床中的运用,并力求为广大患者提供更专业、更个体化的诊疗服务。手术特色为单孔腹腔镜减重手术、磁辅助单孔/减孔腹腔镜减重手术。目前接受治疗的患者在减重、降糖、控制代谢综合征等方面均取得良好的效果,得到“胖友”及“糖友”的一致好评。经过十余年的发展,手术量处于西北领先、国内一流行列。学术研究方面,团队成员主持及参与国家级及省部级课题项目20余项、各类横向课题10余项,已累计发表论文100余篇,其中SCI论文60余篇,多篇论文于Science Advances、Molecular Cancer、Cell Death & Differentiation等国际权威期刊发表。团队成员参与编写多部肝胆及减重代谢外科相关的指南共识和医学教材,并多次获得中国肥胖与2型糖尿病手术精英赛金奖等奖项和荣誉。团队成员王宇锋入选高层次人才计划-陕西高校“青年杰出人才支持计划”,并先后以国家公派联合培养博士和博士后身份师从2019年诺贝尔生理学或医学奖获得者、美国科学院院士、美国医学院院士、美国艺术与科学院院士、美国约翰霍普金斯大学医学院Gregg Semenza教授,从事缺氧对肿瘤进展的调控机制研究。
论文链接:https://www.nature.com/articles/s41418-024-01419-x.
