近日,我院生物样本库李晓娇副研究员联合西安交通大学药学院张继业教授在医工交叉领域顶级期刊《Advanced Materials》(TOP期刊,影响因子26.8)上发表题为《An Epigenetic Nanoagonist Facilitates T Cell Priming, Recruitment, and Reinvigoration in Tumors Resistant to PD-L1 Therapy》的研究论文。

近年来,PD-1/PD-L1免疫检查点阻断疗法在肿瘤治疗领域取得了革命性进展,针对该通路的抗体药物已在多种恶性肿瘤中展现出持久且显著的疗效。然而,随着临床应用的深入,PD-L1耐药问题日益凸显,成为当前肿瘤免疫治疗面临的主要挑战。研究表明,此类耐药主要源于肿瘤微环境(TME)中T细胞所面临的“三重禁锢”:T细胞启动不足导致的免疫应答迟钝、募集能力受损引发的浸润障碍,以及替代性免疫检查点(如PVR-TIGIT轴)上调所致的T细胞功能耗竭。如何系统性的克服T细胞的上述缺陷,成为逆转PD-L1耐药的关键问题。
针对这一难题,本研究从协同调控T细胞的多重缺陷入手,创新性的提出多层级T细胞重塑策略:1)通过表观遗传药物iCARM1(精氨酸甲基转移酶CARM1抑制剂)激活肿瘤细胞内cGAS-STING信号通路,促进树突状细胞(DC)成熟,从而增强T细胞启动;2)利用iCARM1上调T细胞表面趋化因子受体CXCR3的表达,改善T细胞向肿瘤部位的迁移与浸润;3)通过 siRNA 沉默肿瘤细胞中的pvr基因,阻断PVR-TIGIT免疫抑制轴,逆转T细胞耗竭,恢复其抗肿瘤活性。该方案或可从根本上突破目前PD-L1耐药性肿瘤的治疗瓶颈。
然而,成功实施该策略面临的挑战是,如何实现药物在肿瘤部位的有效靶向富集,从而在提升治疗效果的同时降低系统性毒性。为此,团队创新性地开发了一种pH响应型介孔二氧化硅(MSN)纳米载药系统。该系统以氨基功能化MSN(NH₂-MSN)为核心,外部包覆带负电的DMMA-PEG(DP)涂层。内核实现了对iCARM1与siPVR的高效装载,不仅显著提高了iCARM1的生物利用度,还有效保护siPVR免于降解。外部涂层能够在肿瘤酸性微环境中特异性脱落,既可防止药物在循环过程中意外泄漏,又能实现肿瘤微环境中的精准药物释放,从而显著降低系统性毒副作用。
实验结果显示,经新型递送系统装载的iCARM1在肿瘤细胞中释放后,激活cGAS–STING–IFN-β信号通路,促进DC成熟与T细胞启动;同时在T细胞中上调CXCR3表达,增强其向肿瘤部位的迁移能力。另一方面,在肿瘤细胞中释放的siPVR,可有效沉默 pvr 基因,破坏PVR-TIGIT相互作用,逆转T细胞的耗竭。值得注意的是,凋亡的肿瘤细胞可通过其与免疫细胞之间的交互作用,持续促进DC成熟,从而进一步增强T细胞免疫应答的强度与广度,最终形成自我增强型的抗肿瘤免疫循环(如图所示)。该策略在三阴性乳腺癌、结直肠癌等多种PD-L1耐药肿瘤模型中均表现出显著抗肿瘤效果,能够有效抑制肿瘤术后复发与远端转移,并诱导产生长效免疫记忆,对二次肿瘤攻击表现出持续的保护作用。
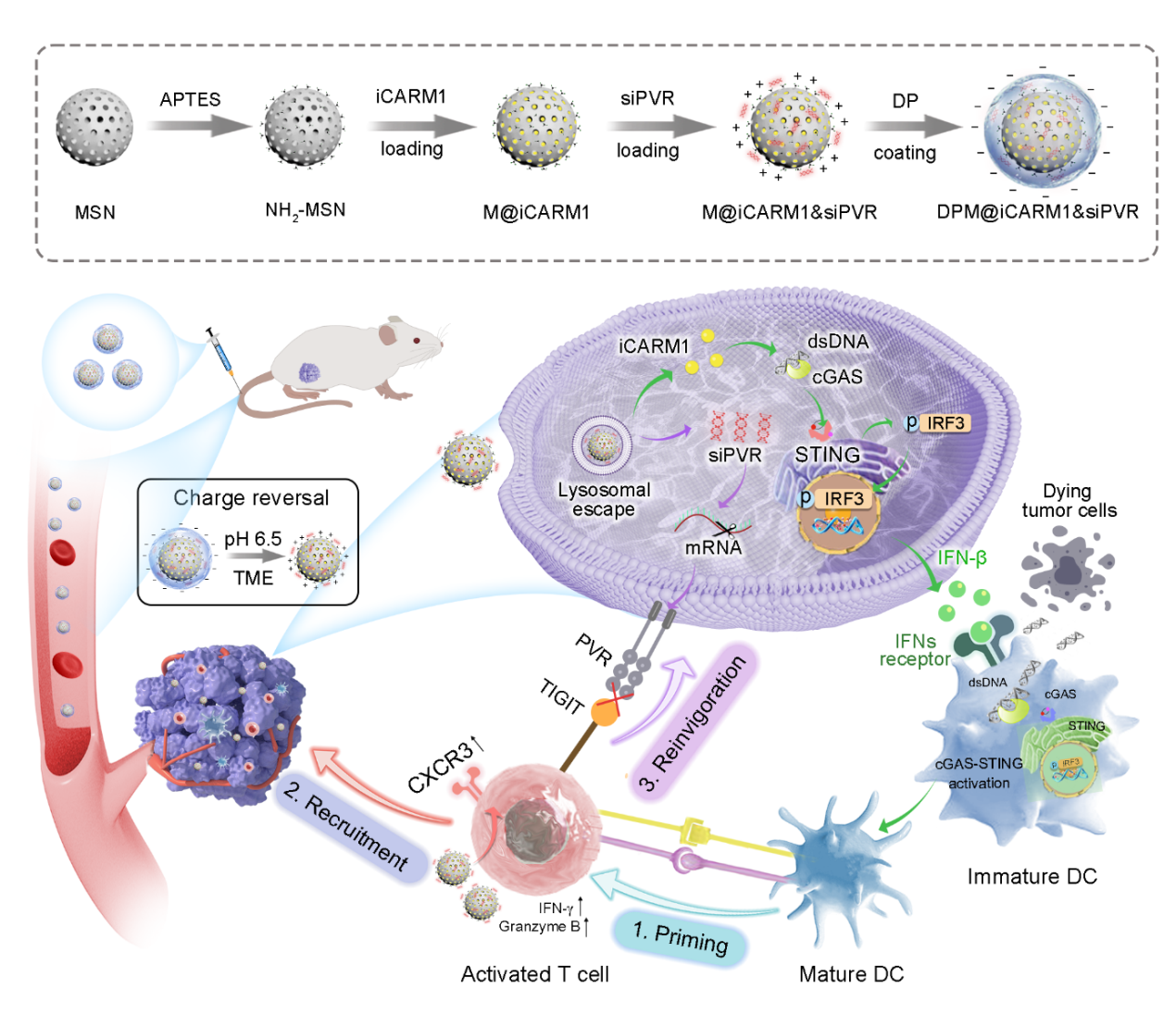
表观遗传纳米激动剂介导的T细胞启动、募集与再激活机制示意图
这项突破性研究开创了表观遗传调控与免疫治疗协同作用的新范式。通过精准干预T细胞的多级功能缺陷,本研究建立了系统性的T细胞重塑策略,有望成为PD-1/PD-L1耐药性肿瘤治疗的新方法。原创的pH响应型纳米载药系统,可实现肿瘤微环境中靶向释放药物,对抗肿瘤药物的高效递送提供了广泛的应用前景。本研究充分体现了医学与材料科学在前沿交叉领域深度融合的重要意义,是我院医工交叉领域又一重要成果。
西安交通大学赵谢君博士生为该文章的第一作者,西安交通大学药学院马佳助理研究员、张继业教授和我院样本库李晓娇副研究员为该论文的共同通讯作者。本研究受国家自然科学基金及陕西省自然科学基金等项目的支持。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/full/10.1002/adma.202502800
